Pengertian Kimia Organik
Kimia organik adalah salah satu bidang ilmu ilmu kimia yang mempelajari struktur, sifat, dan komposisi suatu senyawa. Kimia organik juga sering disebut sebagai kimia karbon, karena unsur yang dipelajari dalam kimia organik adalah unsur yang mengandung karbon, hidrogen, oksigen, biasanya dengan tambahan nitrogen, belerang, dan fosfor. Salah satu contoh senyawa organik adalah TNT (trinitrotoluena) yang digunakan sebagai bahan peledak. TNT tersusun atas atom-atom karbon, hidrogen, oksigen, dan nitrogen. Di bawah ini adalah struktur dua dan tiga dimensi (versi balls and sticks) dari senyawa TNT. Atom hitam adalah karbon, abu-abu adalah hidrogen, merah adalah oksigen, dan biru adalah nitrogen.Setiap makhluk hidup tersusun atas senyawa organik. Diambil istilah organik karena dahulu kala banyak senyawa yang disintesis dari makhluk hidup, seperti selulosa, pati, lemak, dll.
Gugus Fungsi dalam Kimia Organik
Salah satu bahasan dalam kimia organik, yang membedakan dengan kimia anorganik adalah adanya sebuah pola yang disebut deret homolog. Setiap senyawa organik mempunyai gugus yang spesifik dimana setiap gugus tersebut berbeda sifat dan reaktivitasnya. Inilah yang disebut gugus fungsional. Gugus fungsi adalah suatu atom atau kumpulan atom yang melekat pada suatu senyawa dan berperan memberikan sifat yang khas pada senyawa.Semua senyawa organik yang mempunyai gugus fungsional yang sama akan ditempatkan pada deret homolog yang sama. Berdasarkan gugus fungsi, dapat dibuat klasifikasi senyawa organik yang memudahkan kimia organik untuk dipelajari.
Materi Kimia Organik
materi kimia organik dibagi menjadi beberapa kategori.Alkana
Sifat fisik alkana. Alkana merupakan suatu senyawa organik. Alkana
merupakan suatu hidrokarbon yang bersifat jenuh, dikarenakan tidak
mempunyai ikatan rangkap. Alkana hanya terdiri dari atom karbon dan hidrogen dengan rumus empiris CnH2n+2. Di sini akan dibahas sifat-sifat fisik dari senyawa alkana pada umumnya.
Wujud Alkana
- Semua alkana tidak berwarna dan memiliki bau yang khas.
- Alkana rantai pendek (C1 sampai C4) berupa gas, rantai sedang (C3 sampai C17) berupa cairan dan jika lebih panjang berbentuk padatan.
- Titik didih alkana meningkat seiring kenaikan berat molekul. Hal ini dikarenakan meningkatnya gaya van der Waals sebanding dengan kenaikan berat molekul.
- Cabang alkana menyebabkan penurunan luas permukaan yang mengakibatkan penurunan gaya van der Waals. Itulah sebabnya titik didih pentana > isopentana > neopentana
- Titik leleh alkana tidak menunjukkan keteraturan. Alkana dengan jumlah atom karbon genap memiliki titik leleh lebih tinggi dibandingkan yang mempunyai jumlah atom karbon ganjil.
- Kecenderungan abnormal pada titik leleh mungkin karena alkana dengan atom karbon ganjil memiliki atom karbon di sisi berlawanan. Jadi alkana dengan atom karbon genap dapat dikemas erat dalam kisi kristal membuat gaya tarik antarmolekul menjadi lebih besar.
Massa Jenis Alkana
Massa jenis alkana meningkat seiring kenaikan berat molekul dan berakhir maksimal pada 0,76 g/mL. Dengan kata lain massa jenis alkana yang paling besar adalah 0,76 g/mL. Jadi semua alkana lebih ringan dari air.Kelarutan Alkana
Alkana bersifat non polar sehingga tidak larut dalam air, tetapi larut dalam pelarut non polar misalnya C6H6 (benzena) , CCl4 (karbon tetraklorida) dll.Pengertian Alkana
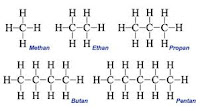
Senyawa organik yang paling sederhana adalah hidrokarbon. Hidrokarbon hanya terdiri dari dua unsur, yaitu karbon (C) dan hidrogen (H). Hidrokarbon jenuh atau yang disebut dengan alkana adalah hidrokarbon yang keseluruhan ikatannya adalah ikatan tunggal. Masing-masing karbon membentuk empat ikatan dan masing-masing hidrogen membentuk satu ikatan dengan karbon. Ikatan pada masing-masing hidrokarbon adalah tetrahedral, dengan sudut ikatan 109,5°. Hasilnya, alkana rantai panjang akan membentuk pola zig zag.Alkana Rantai Lurus
Rumus umum alkana adalah CnH2n+2 dimana n adalah jumlah atom karbon pada molekul alkana. Ada dua buah cara untuk menulis rumus struktur. Sebagai contoh, buatana dapat dituliskan sebagai CH3CH2CH2CH3 atau CH3(CH2)2CH3.| Jumlah Karbon | Nama | Rumus Molekul | Rumus Struktur |
| 1 | Metana | CH4 | CH4 |
| 2 | Etana | C2H6 | CH3CH3 |
| 3 | Propana | C3H8 | CH3CH2CH3 |
| 4 | Butana | C4H10 | CH3CH2CH2CH3 |
| 5 | Pentana | C5H12 | CH3CH2CH2CH2CH3 |
| 6 | Heksana | C6H14 | CH3(CH2)4CH3 |
| 7 | Heptana | C7H16 | CH3(CH2)5CH3 |
| 8 | Oktana | C8H18 | CH3(CH2)6CH3 |
| 9 | Nonana | C9H20 | CH3(CH2)7CH3 |
| 10 | Dekana | C10H22 | CH3(CH2)8CH3 |
Tata Nama Alkana
- Nama induk alkana diambil dari rantai terpanjang
- Jika ada dua atau lebih rantai yang panjangnya sama, maka diambil yang mempunyai cabang terbanyak.
- Rantai karbon dihitung dari cabang terdekat.
- Jika ada dua macam cabang yang dekatnya sama, maka dihitung dari cabang terdekat berikutnya.
- Jika ada cabang yang sama, maka ada awalan sesuai dengan jumlah cabang yang sama, yaitu di-, tri- tetra- berturut-turut untuk dua, tiga, dan empat cabang yang sama.
Alkana Bercabang
- Cabang (substituen) yang mempunyai cabang, dinomori dari karbon substituen yang melekat pada rantai induk.
- Penomoran substituen dimulai dari karbon yang melekat pada rantai induk.
- Keseluruhan nama dari cabang substituen ditulis dalam kurung, dengan didahului nomor yang mencerminkan induk yang mana karbon itu bergabung.
- Substituen ditulis urut abjad. Untuk mengurutkan sesuai abjad, abaikan awalan (di-, tri, tetra-) tetapi jangan abaikan posisi seperti iso- dan tert-
Alkana Siklis
- Rantai induk ditentukan dari karbon yang membentuk cincin terbesar (misal, sikloalkana adalah sikloheksana)
- Ketika dua cincin bergabung, cincin yang lebih besar adalah yang menjadi rantai induk, sedangkan yang kecil menjadi cabang sikloalkil.
Penggunaan Alkana
Senyawa alkana dekat dengan kehidupan manusia. Penerapan senyawa alkana dalam kehidupan sehari-hari adalah sebagai berikut:- Metana untuk bahan bakar roket
- Butana untuk pengisi korek api
- Pentana banyak digunakan untuk kebutuhan industri
- Heksana dapat digunakan untuk mengisolasi senyawa alam yang sifatnya non polar
- Pentana (bensin) digunakan untuk kendaraan bermotor.
- Iso-oktana adalah bensin dengan kualitas tinggi (biasa disebut pertamax)
- Sebagai bahan pembuatan polimer
- Sebagai intermediet dalam sintesis senyawa organik
Bilangan Oktan
Pada bahan bakar bensin, biasanya dikenal dengan bilangan oktan. Bilangan oktan adalah menyatakan persentase kandungan senyawa iso-oktana di dalam bahan bakar bensin. Misalnya, suatu pertamax mempunyai bilangan oktan 95. Hal itu berarti pertamax tersebut terdiri atas 95% iso-oktana dan sisanya (5%) pentana.Semakin tinggi bilanagan oktan, maka semakin bagus. Bahan bakar bensin dengan bilangan oktan rendah akan menghasilkan jelaga (arang) yang banyak.
Pada dasarnya, senyawa alkena dapat dinamai dengan cara sistem IUPAC maupun nama umum (trivial). Masing-masing tata nama alkena tersebut akan dibahas sat per satu di sini.
Nama IUPAC Alkena
Menurut aturan IUPAC, tata nama alkena berasal dari alkana yang berakhiran -ana menjadi alkena yang berakhiran -ena. Sebagai contoh yang sederhana, 1-pentena mempunyai rumus CH2=CHCH2CH2CH3, sedangkan 2-pentena mempunyai rumus struktur CH3CH=CHCH2CH3. Pemberian angka 1 dan 2 di depan nama pentena tersebut tentu saja merujuk pada posisi ikatan rangkap dua dalam senyawa. Karbon-karbon dalam alkena yang rumit dinamai sedemikian rupa sehingga karbon yang berikatan rangkap dinomori dengan nomor yang paling rendah. Perhatikan senyawa berikut ini:Pada senyawa 3-metil-2-propil-1-pentena di atas, yang menjadi rantai utama adalah yang mempunyai ikatan rangkap (terdiri dari 5 atom karbon). Maka senyawa tersebut dinamai dengan 1-pentena sesuai dengan jumlah rantai induknya.
Nama Trivial Alkena
Nama trivial adaah nama umum yang diberikan kepada beberapa struktur khusus alkena. Sebagai contoh, etena mempunyai nama trivial etilena; propena mempunyai nama trivial propilena; dan 2-metilpropena mempunyai nama trivial isobutilena.Ada juga nama gugus fungsi trivial alkena yang didasarkan pada kedudukan dan jumlah rantai alkena. Sebagai contoh gugus alkenil CH2= diberi nama metilena; gugus fungsi CH2=CH- diberi nama vinil; dan CH2=CH-CH2 diberi nama alil.
Pengertian Alkena
Alkena merupakan salah satu senyawa hidrokarbon alifatik yang bersifat tidak jenuh, tetapi cukup bersifat reaktif. Istilah yang digunakan adalah tidak jenuh, yang menandakan bahwa alkena mengandung atom hidrogen yang kurang dari jumlah semestinya, jika dihubungkan dengan jumlah atom karbonnya.Gugus fungsi alkena yang utama adalah adanya ikatan rangkap dua antar karbon (C=C). Gugus fungsi ini sangat mempengaruhi reaksi pada golongan alkena. Secara umum, reaksi yang dapat terjadi pada alkena dapat dikategorikan menjadi dua jenis, yaitu reaksi pada ikatan rangkap dan reaksi di luar ikatan rangkap. Reaksi alkena yang terjadi pada ikatan rangkap dinamakan reaksi adisi, sedangkan di luar katan rangkap dinamakan reaksi substitusi.
Hidrokarbon alifatik tak jenuh dapat juga mengandung lebih dari satu ikatan rangkap, sebagai contoh adalah senyawa alkadiena. Alkadiena adalah hidrokarbon alifatik tak jenuh yang mengandung dua buah ikatan rangkap.
Struktur Alkena
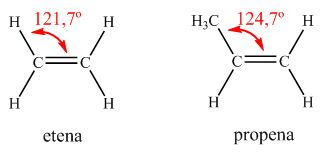
Alkena merupakan hidrokarbon tidak jenuh dengan sebuah ikatan rangkap. Suatu alkena mengikuti rumus umum CnH2n. Sebagai contoh adalah etena yang mempunyai rumus molekul C2H4 dan propena yang mempunyai rumus molekul C3H6. Inilah rumus struktur etena dan propena:Berdasarkan teori tolakan pasangan elektron valensi (Valence Shell Electron Pair Repulsion, VSEPR), dapat diramalkan bahwa ikatan antar karbon membentuk sudut sekitar 120º, walaupun nyatanya tidak selalu tepat demikian. Pada gambar di atas, etena mempunyai sudut ikatan sebesar 121,7º, sedangkan sudut ikatan pada propena adalah 124,7º. Besarnya sudut ikatan ini dipengaruhi oleh besarnya gugus yang terikat oleh atom karbon yang mempunyai ikatan rangkap. Sudut akan semakin besar jika gugus yang diikat juga semakin besar.
Tumpang Tindih Orbital Alkena
Jika ada ikatan rangkap dua, maka ikatan tersebut terdiri atas satu ikatan pi (π) dan satu ikatan sigma (σ). Kedua jenis ikatan ini berbeda jauh. Ikatan sigma bersifat sangat kuat (tidak mudah putus) dan dapat berotasi (berputar). Ikatan pi bersifat lemah (mudah putus) dan tidak dapat berotasi. Atom karbon yang berikatan rangkap menggunakan tiga buah orbital membentuk model hibridisasi sp2 membentuk ikatan sigma dengan tiga atom yang lain. Ketiga orbital hibrida tersebut membentuk sudut 120º dalam satu bidang. Sedangkan orbital atom 2p yang tidak terhibridisasi mempunyai orientasi tegak lurus terhadap orbital sp2. Apabila kedua orbital atom 2p yang tidak terhibridisasi tersebut bersifat paralel, maka akan terjadi peristiwa tumpang tindih sehingga membentuk ikatan pi pada ikatan rangkap dua.Diperlukan energi 63 kkal/mol untuk memutus ikatan pi dalam molekul etena. Energi yang dibutuhkan lebih besar dariada energi termal pada temperatur kamar. Akibatnya, ikatan tersebut tidak bisa berotasi. Keadaan tersebut tidak berlaku pada etana, yang hanya mempunyai ikatan sigma sehingga bebas untuk berotasi.
Spektrum Alkena
Spektrum IR Alkena
Etilena, tetrakloroetilena dan alkena lain berisi ikatan rangkap non polar C=C yang tidak menyerap radiasi dalam daerah C=C. Alkena seperti RR'C=CHR dan alkena tidak simetri lainnya berisi ikatan rangkap polar C=C dan jadi menyerap radiasi inframerah. Uluran ikatan rangkap C=C menimbulkan absorbsi pada 1600-1700 cm-1. Karena ikatan rangkap itu tidak polar, uluran ini hanya mengakibatkan perubahan kecil dalam momen ikatan. Akibatnya absorpsi itu lemah, 10 sampai 100 kali lebih lemah daripada absorpsi gugus karbonil. Absorpsi yang ditimbulkan oleh uluran ikatan karbon-hidrogen vinilik atau alkenil (=C-H) pada kira-kira 3000-3100 cm-1 juga lemah. Ikatan karbon-karbon alkenil menunjukkan absorbsi tekukan dalam daerah sidik jari spektrum inframerah.Spektrum NMR Alkena
Pergeseran kimia untuk proton vinil (ikatan rangkap di ujung) terjadi dengan nilai δ sekitar 5,0 ppm. Posisi yang pasti pada absorpsi ini bergantung pada letak ikatan rangkap C=C dalam rantai hidrokarbon. Pada umumnya proton pada karbon alkenil ujung (terminal) menyerap di dekat 4,7 ppm, sedangkan proton pada karbon alkenil bukan ujung sedikit lebih ke bawah medan pada nilai δ sekitar 5,3 ppm.Manfaat Alkena
Penggunaan alkena dalam kehidupan adalah:- Bahan pembuatan etanol dan etilen glikol.
- Bahan pembuatan plastik seperti polietilen
- Bahan pematangan buah seperti nanas, apel, dan jeruk.
Alkuna
Wujud Alkuna
Tiga alkuna dengan rantai anggota terpendek (etuna, propuna, dan butuna) merupakan gas tak berwarna dan tak berbau. Adanya pengotor berupa gas fosgen (ClCOCl), etuna (asetilena) berbau seperti bawang putih. Delapan anggota selanjutnya berwujud cair, dan jika rantai semakin panjang maka wujud alkuna adalah padatan pada tekanan dan temperatur standar. Semua alkuna mempunyai massa jenis lebih kecil daripada air.Kelarutan Alkuna
Alkuna tidak larut dalam air, namun cukup larut dalam pelarut organik seperti benzena, eter, dan karbon tetraklorida.Titik Leleh dan Titik Didih Alkuna
Titik leleh dan titik didih alkuna semakin meningkat seiring dengan kenaikan massa molekul. Selain itu, titik leleh dan titik didih alkuna dipengaruhi oleh percabangan, seperti halnya alkana dan alkena. Contoh titik leleh alkuna adalah:
Golongan Alkuna
Pengertian Alkuna
Alkuna adalah suatu golongan hidrokarbon alifatik yang mempunyai gugus
fungsi berupa ikatan ganda tiga karbon-karbon (-C≡C-). Seperti halnya
ikatan rangkap dalam alkena, ikatan ganda tiga dalam alkuna juga disebut
ikatan tidak jenuh. Ketidakjenuhan ikatan ganda tiga karbon-karbon
lebih besar daripada ikatan rangkap. Oleh karena itu kemampuannya
bereaksi dengan pereaksi-peraksi yang dapat bereaksi dengan alkena juga
lebih besar. Hal inilah yang menyebabkan golongan alkuna memiliki
peranan khusus dalam sintesis senyawa organik.
Struktur Alkuna
Alkuna merupakan golongan hidrokarbon yang memiliki ikatan ganda tiga (istilah "ganda tiga" digunakan untuk membedakan "rangkap dua" milik alkena). Dengan demikian alkuna juga termasuk hidrokarbon tidak jenuh. Rumus umum untuk senyawa alkuna adalah CnH2n-2. Karena sebuah senyawa alkuna memiliki minimal satu ikatan ganda tiga, maka senyawa alkuna yang paling kecil adalah etuna (C2H2) dengan rumus struktur HC≡CH. Dengan demikian, dapat dipahami bahwa bentuk tiga dimensi dari etuna adalah linier, dengan sudut ikatan sebesar 180º dengan panjang ikatan sebesar 0,121 nm.Tumpang Tindih Orbital Alkuna
Teori ikatan valensi (Valence Bond Theory) mengatakan bahwa ikatan ganda tiga merupakan hasil bentukan dari tumpang tindih orbital hibridisasi sp dari atom-atom karbon yang bersebelahan. Dengan demikian akan terbentuk ikatan sigma (σ) dan ikatan pi (π). Ikatan tersebut terbentuk dari tumpah tindih dua buah orbital 2py yang bersifat paralel, dan sebuah ikatan pi (π) kedua yang terbentuk dari tumpah tindih orbital 2pz yang juga bersifat paralel.Spektrum Alkuna
Spektrum IR Alkuna
Frekuensi uluran C≡C alkuna terjadi pada 2100-2250 cm-1 (4,4-4,8 μm). Absorpsi ini sangat lemah dan mudah terbenam dalam bisingan (crowded) latar belakang spektrum. Namun tak ada gugus yang menyerap di daerah ini kecuali C≡N (gugus nitril) dan Si-H. Frekuensi uluran ≡C-H dijumpai pada kira-kira 3300 cm-1 (3,0 μm)sebagai suatu peak yang tajam.Spektrum NMR Alkuna
Suatu alkuna dengan tipe RC≡CR tak mempunyai proton yang bersifat asetilenik. Dengan demikian alkuna yang bersubstitusi ganda tidak mempunyai absorpsi NMR yang khas (tetapi pada bagian lain dari molekul dapat menimbilkan absorpsi). Suatu alkuna substitusi tunggal, RC≡CH menunjukkan absorpsi untuk proton alkunil pada nilai δ sekitar 3 ppm. Absorpsi ini tidak sebawah medan seperti absorpsi untuk proton vinil atau aril, karena proton alkunil terperisai oleh medan imbasan ikatan ganda tiga.Penggunaan Alkuna
Manfaat alkuna dalam kehidupan adalah:- Gas asetilena (etuna) digunakan untuk bahan bakar las. Ketika asetilena dibakar dengan oksigen maka dapat mencapai suhu 3000º C. Suhu tinggi tersebut mampu digunakan untuk melelehkan logam dan menyatukan pecahan-pecahan logam.
- Asetilena terklorinasi digunakan sebagai pelarut. Asetilena klorida juga digunakan untuk bahan awal pembuatan polivinil klorida (PVC) dan poliakrilonitril.
- Karbanion alkuna merupakan nukleofil yang sangat bagus dan bisa digunakan untuk menyerang senyawa karbonil dan alkil halida untuk melangsungkan reaksi adisi. Dengan demikian sangat penting untuk menambah panjang rantai senyawa organik.


Tidak ada komentar:
Posting Komentar